
**產品監管文件
《**產品衛生安 全評價規定》(衛監督發〔2009〕105號),為加強取消許可的**產品的事后監督管理,建立衛生安 全評價制度。
《**產品衛生安 全評價規定》(國衛監督發〔2014〕36號)和《**產品衛生監督工作規范》(國衛監督發〔2014〕40號)按照**產品用途、使用對象實行風險監管,將**產品分為三類監管。產品責任單位應當在**類、第二類**產品**上市前自行或者委托第三方進行衛生安 全評價,形成《**產品衛生安 全評價報告》。衛生安 全評價合格的**產品方可上市銷售。
《**產品衛生安 全評價技術要求》(WS 628-2018)作為**產品衛生安 全評價技術要求**制定的強制性衛生標準,與《**產品衛生安 全評價規定》(國衛監督發〔2014〕36號)配套使用。
**產品分類
按照**產品用途、使用對象的風險程度將**產品分為三類:
1、是具有較高風險,需要嚴格管理以保 證安 全、有效的**產品,包括用于醫療器械的高水平**劑和**器械、滅 菌劑和滅 菌器械,皮膚、黏膜**劑,生物指示物、滅 菌效果化學指示物。
2、是具有中度風險,需要加強管理以保 證安 全、有效的**產品,包括除**類產品外的**劑、**器械、化學指示物,以及帶有滅 菌標識的滅 菌物品包裝物、抗(抑)菌制劑。
3、是風險程度較低,實行常規管理可以保 證安 全、有效的除抗(抑)菌制劑外的衛生用品。(注:不需要備案)
其中食具消毒柜屬于第二類消毒產品。
同一個**產品涉及不同類別時,應當以較高風險類別進行管理。
消毒產品衛生安 全評價
適用范圍
消毒產品衛生安 全評價適用于在**境內生產、經營的不需要行政審批的消毒類、第二類消毒產品。
具體檢驗項目及要求
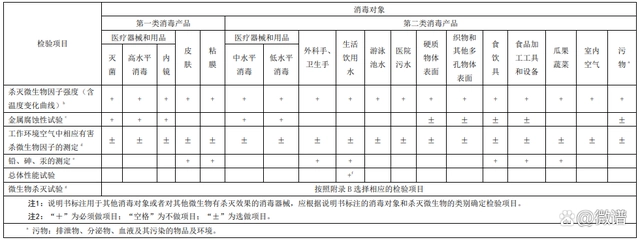
根據《**產品衛生安 全評價技術要求》(WS 628-2018)要求,具體檢驗項目如下:
**器械檢驗項目
衛生安 全評價報告模板
詳見《**產品衛生安 全評價技術要求》(WS 628-2018)附 錄 A(規范性附錄)**產品衛生安 全評價報告格式。
備案類型與要求
**備案
產品責任單位應當在**類、第二類**產品**上市前自行或者委托第三方進行衛生安 全評價,形成《**產品衛生安 全評價報告》,對評價結果負責。衛生安 全評價報告資料齊全并符合要求。
備案材料包括基本情況和評價資料:
基本情況,包括封面、基本情況表、評價資料目錄和備案登記表;
市售標簽(銘牌)、市售說明書;
檢驗報告(含結論);
國產產品備案企業標準或進口產品質量標準;
國產產品生產企業衛生許可證或進口產品生產國(地區)允許生產銷售的證明文件及報關單;
**劑、抗(抑)菌制劑產品**;
**器械結構圖(主要元器件及參數);
其他(產品照片、委托加工合同、商標文件等)。
更新備案
上市后的**產品有以下情形改變的,產品責任單位應對相關檢驗項目重新檢測并更新評價資料:
a)實際生產地址遷移、另設分廠或車間、轉委托生產加工的;
b)**劑、抗(抑)菌制劑、生物指示物、化學指示物、帶有滅 菌標識的滅 菌物品包裝物及PCD延長產品有效期的;
c)**劑、**器械和抗(抑)菌制劑增加使用范圍或改變使**產品衛生安 全評價報告更新情況真實,變更內容資料齊全并符合要求。
備案材料包括:
基本情況,包括更新備案情況說明、封面、基本情況表、評價資料目錄和備案登記表;
市售標簽(銘牌)、市售說明書;
檢驗報告(含結論);
國產產品備案企業標準或進口產品質量標準;
國產產品生產企業衛生許可證或進口產品生產國(地區)允許生產銷售的證明文件及報關單;
**劑、抗(抑)菌制劑產品**;
**器械結構圖(主要元器件及參數);
其他(產品照片、委托加工合同、商標文件等)。
重新備案
**產品衛生安 全評價報告重新備案須產品屬于**類**產品,對產品關鍵項目進行重新檢驗。兩年內國 家監督抽查合格的檢驗項目可不再做。
備案材料包括:
基本情況,包括重新備案情況說明、封面、基本情況表、評價資料目錄和備案登記表;
市售標簽(銘牌)、市售說明書;
檢驗報告(含結論);
國產產品備案企業標準或進口產品質量標準;
國產產品生產企業衛生許可證或進口產品生產國(地區)允許生產銷售的證明文件及報關單;
**劑、抗(抑)菌制劑產品**;
**器械結構圖(主要元器件及參數);
其他(產品照片、委托加工合同、商標文件等)。
備案服務平臺
**產品責任單位在**類和第二類**產品**上市前需要進行衛生安 全評價,可將有關衛生安 全評價報告錄入**信息服務平臺進行備案。
**信息服務平臺于2018年10月8日上線運行,主要是為****產品責任單位提供**產品衛生安 全評價網上備案服務,為社會監督和信息查詢、社會信用體系建設、監督機構開展事中事后監督執法提供規范統一的信息服務。
申請方式
網上申請:責任單位通過**一體化政務服務平臺或****產品網上備案信息服務平臺上傳備案材料電子檔。
備案基本流程如下:
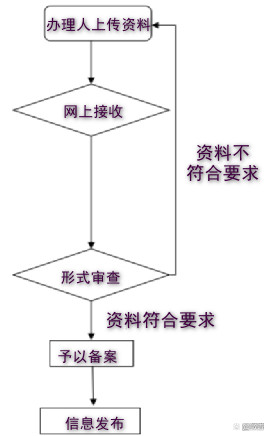
審查形式
省(市)衛生健康行政部門對**產品衛生安 全評價報告備案材料進行形式審查。對通過形式審查的**產品衛生安 全評價報告予以備案;對形式審查未通過的,在平臺上遠程反饋需補充提交或修改材料的意見。對產品責任單位上傳的無須衛生安 全評價的產品相關材料直接予以退回。
**產品衛生安 全評價報告形式審查內容包括資料的完整性、規范性和合法性。
(一)完整性審查包括以下內容:
1.材料齊全,應當符合《**產品衛生安 全評價規定》、《**產品衛生安 全評價技術要求》(WS 628-2018)和本辦法的規定;
2.填寫內容應當完整、無漏項和缺項;
3.檢驗項目齊全,應當符合《**產品衛生安 全評價規定》和《**產品衛生安 全評價技術要求》(WS 628-2018)的規定。
(二)規范性審查包括以下內容:
1.材料內容應當前后一致,如產品名稱、劑型/型號、責任單位和實際生產企業名稱、實際生產地址等;
2.材料應當清晰,無涂改;
3.材料逐頁加蓋責任單位公章,**產品生產企業衛生許可證復印件還需加蓋實際生產企業公章。
(三)合法性審查包括以下內容:
1.產品名稱、標簽(銘牌)、說明書應當符合《**產品標簽說明書通用要求》(GB 38598-2020)的有關規定,不得使用已批準的藥品名;
2.產品標簽說明書不得出現或暗示疾病..效果;
3.國產產品的企業標準依法備案并在有效期內;
4.國產產品的**產品生產企業衛生許可證在有效期限內,且備案產品在許可核準的生產類別范圍內。
備案信息發布
省(市)衛生健康行政部門將批準備案的**產品信息在****產品網上備案信息服務平臺上予以公開,涉及商業秘密的信息不予公開。
信息發布內容包括產品名稱、產品風險程度分類(**類或第二類)、劑型、型號、規格、使用范圍、產品責任單位名稱和統一社會信用代碼、實際生產企業名稱、**產品生產企業衛生許可證號、衛生安 全評價結論、評價日期、市售產品標簽、銘牌、說明書、檢驗報告、備案日期等。
事中事后監管
省衛生健康行政部門負責本省**產品監管工作,充分利用網絡平臺,加強**類、第二類**產品衛生安 全評價報告備案情況巡查,建立省、市、縣際間協查機制。
地方各級衛生健康行政部門及衛生監督執法機構開展本轄區**產品生產企業和**產品監督執法工作,將當年備案的**產品納入年度重點抽查內容。同時,將**產品衛生安 全評價報告備案和事中事后監管結果應用于企業信用體系建設,建立政府部門間協同監管、信息共享、聯合懲戒等綜合監管機制。
參考資料:
《**產品標簽說明書通用要求》(GB 38598-2020)
《**產品衛生安 全評價技術要求》(WS 628-2018)
《**產品衛生安 全評價規定》(國衛監督發〔2014〕36號)
《**產品衛生監督工作規范》(國衛監督發〔2014〕40號)
《**產品衛生安 全評價報告網上備案辦事指南》
 當前位置:
當前位置:
